近期,上海交通大学樊春海团队联合上海大学、华东理工大学等共同研发了一种新型框架核酸荧光探针,用于活体动物近红外二区窗口(1000-1700 nm,NIR-II)荧光成像与手术导航。这种探针具有高亮度的荧光、高组织穿透能力和高光稳定性,可灵敏探测肿瘤模型小鼠体内接近单个肿瘤细胞的荧光信号,并展示了长时间追踪活体肿瘤生长与转移的能力。该研究成果近期发表在《自然·光子学》(Nature Photonics)杂志上。
恶性肿瘤易产生侵袭性微转移,对早期诊断和手术治疗带来了巨大的挑战。目前的成像探针难以同时兼顾高灵敏度、深部组织穿透性和组织特异性。NIR-II的荧光成像显示出更好的组织穿透性、低背景自发荧光和最小的光子散射,具有很高的信噪比,在体内成像和图像引导手术中显示出巨大的前景。然而,目前尚缺乏设计NIR-II探针的通用途径,可同时满足超高灵敏度、深组织穿透性和组织特异性的要求。
为解决这些问题,研究团队基于框架核酸发展了一种通用平台,可封装各种类型的疏水性荧光染料。特别的,研究者通过将小分子荧光染料Sq964非共价封装到疏水性纳米腔中,构建了具有大小和形状分辨能力的框架核酸荧光点(FDF dots),该材料具有超高亮度、厘米级深层组织穿透性、高光稳定性和良好的肿瘤滞留率。研究团队应用该材料展示了近单细胞水平的超高灵敏NIR-II癌症成像,并成功将其应用于成像引导的微小肿瘤病灶的手术切除。

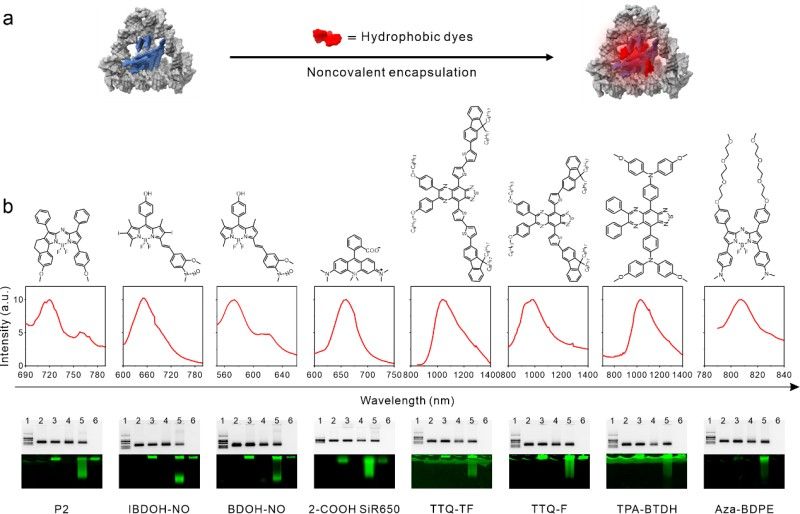
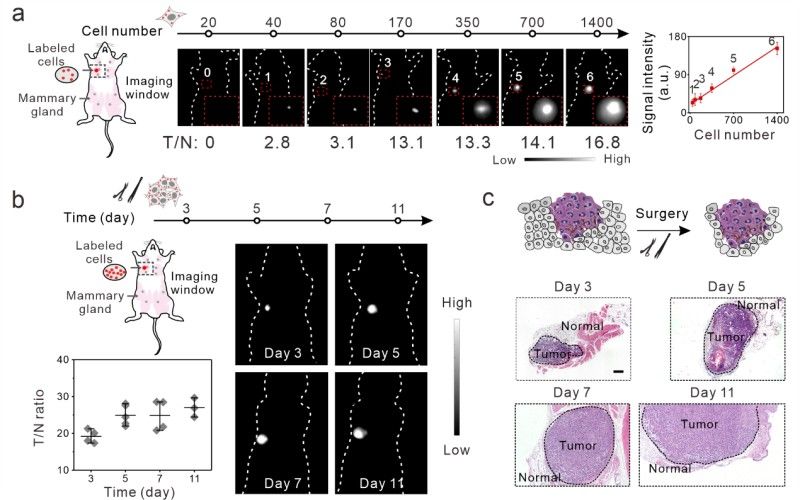
这项工作得到国家重点研发计划,国家自然科学基金,上海市2022年度"科技创新行动计划"基础研究领域项目的资助。
论文链接:https://www.nature.com/articles/s41566-024-01543-7

 English
English


