近日,上海交通大学变革性分子前沿科学中心的商明课题组开发了一类新型大位阻手性双噁唑啉配体,实现了首例氨基酸和多肽衍生的吡啶盐与非活化烯烃的不对称脱氨烷基化反应,相关工作发表在Journal of the American Chemical Society上。

烷基胺广泛存在于生物活性分子、药物分子,有机材料分子以及一些高附加值有机化学品中。在此驱动下,化学家近几年来开始探索通过使用烷基胺化合物代替烷基卤代烃,通过sp3C–N键的切断来构建sp3碳中心骨架。迄今为止,报导的方法都是从光学纯的手性胺出发,通过立体专一性反应构建sp3碳中心,并且底物局限于苄位,烯丙位,炔丙位(图1a),而利用消旋的底物通过立体收敛方式实现不对称脱氨官能化的反应还未有报道。主要原因是不对称脱氨sp3偶联反应具有以下挑战:首先,吡啶盐的脱氨活化多经历单电子转移机理,其立体选择性较难控制,并且消旋底物的不对称脱氨偶联反应未有报道,可参考文献较少;其次,反应中会生成当量的三苯基吡啶副产物,可能会竞争手性配体与金属的配位,从而降低产物的对映选择性;第三,不同取代烯烃及内烯烃潜在的区域选择性问题。
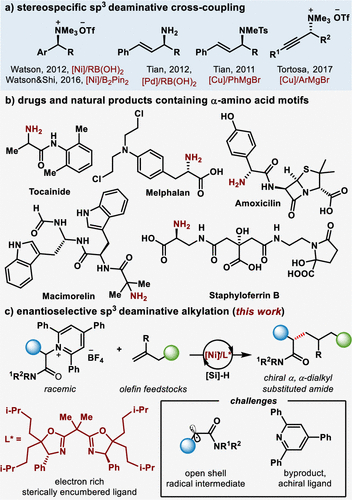
图1. 不对称脱氨烷基化反应介绍
由于α-氨基酸骨架在天然产物、药物及生物活性分子中普遍存在(图1b),作者选择使用α-氨基酸的吡啶盐衍生物以及廉价易得的非活化烯烃作为sp3亲核试剂前体来尝试不对称脱氨偶联反应,构建sp3-sp3骨架。经过一系列的条件筛选(图2),以96:4 er 和86%的产率得到了脱氨烷基化产物。值得一提的是,在配体筛选过程中,作者设计合成了一种新的大位阻双噁唑啉配体,提升了低温条件下反应的活性和对映选择性,这也是此反应得以实现的一个关键。

图2. 反应配体筛选和条件优化
在获得最优条件之后,作者对该反应的普适性进行了详细的考察,各种非活化烯烃及氨基酸衍生物均可以兼容,此外,复杂天然产物和药物分子衍生的烯烃也能顺利进行反应,为合成手性的α, α-二取代酰胺提供了一条快捷,高效的途径,展示了较好的应用前景。

 English
English


