截至2022年9月18日,新型冠状病毒(SARS-CoV-2)已致全球6.08亿人感染,其中包括650万死亡病例,是本世纪最为严重的全球公共性卫生事件。SARS-CoV-2是通过高度糖基化的刺突蛋白(Spike, S)上的受体结合域(RBD)与人体中的受体蛋白血管紧张素转换酶(ACE2)结合,进而入侵人体细胞。因此,糖基化RBD蛋白是疫苗开发的主要抗原与中和抗体的关键靶标。基因重组RBD蛋白的糖链异质性可能导致抗体中和效果不完整,进而影响疫苗的免疫原性。只有制备具有均一糖链结构的RBD蛋白,才能深入了解糖基化对病毒功能的影响,同时可以为抗体药物的进一步研发以及疫苗研制提供技术支撑。

2021年3月11日,上海交通大学化学化工学院化学生物学研究所王平课题组在《Angewandte Chemie International Edition》期刊上发表题为“Synthetic Homogeneous Glycoforms of the SARS-CoV-2 Spike Receptor-Binding Domain Reveals Different Binding Profiles of Monoclonal Antibodies”的突破性研究成果。课题组结合蛋白质化学、糖化学和蛋白表达技术,分别以单糖、核心五糖以及复杂型九糖为N型糖链,氨基半乳糖为O型糖链,通过两步“自然化学连接”实现了六种不同糖型RBD蛋白的汇聚式高效大量合成。
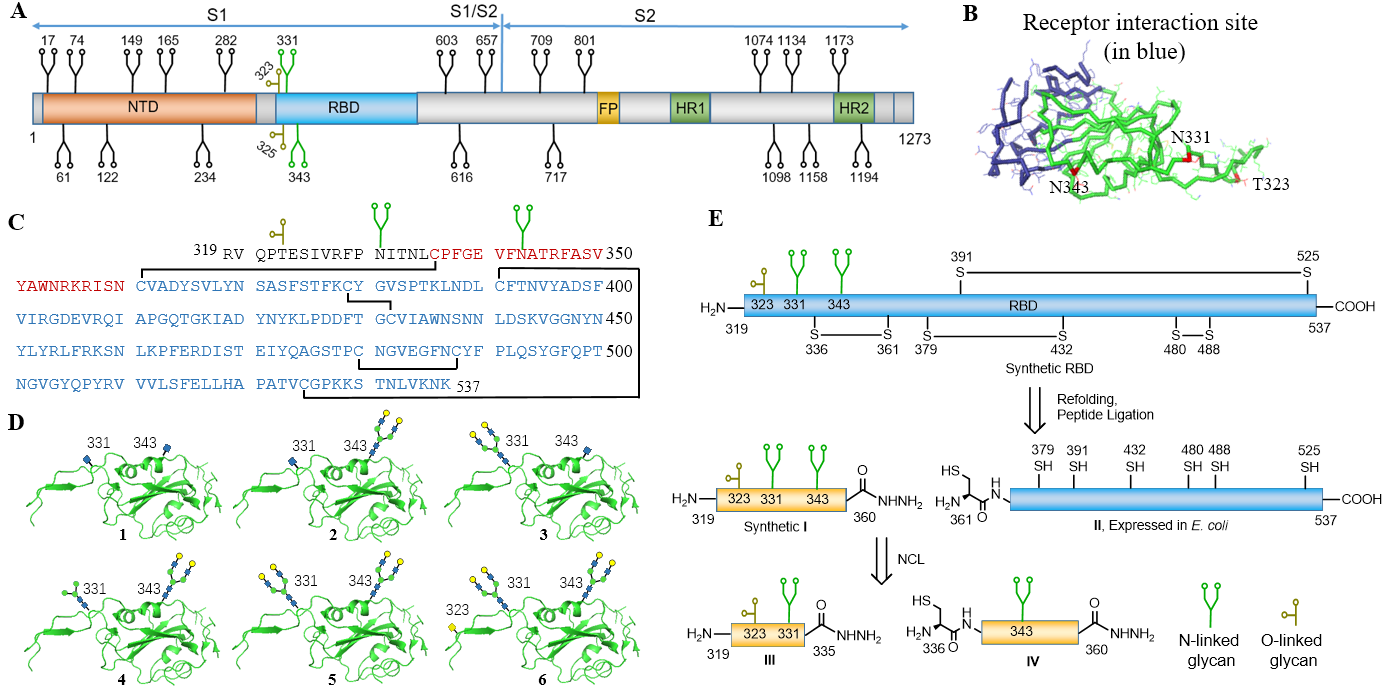
研究人员通过表面等离子共振实验探究了不同糖基化RBD与受体蛋白和抗体之间的结合作用,实验结果表明RBD蛋白的糖基化程度对其与ACE2的结合没有明显的影响。与临床获批的中和抗体(S309, CB6等)结合力测试显示:抗体靶点为糖基化区域时,糖基化对病毒的免疫逃逸效应明显。
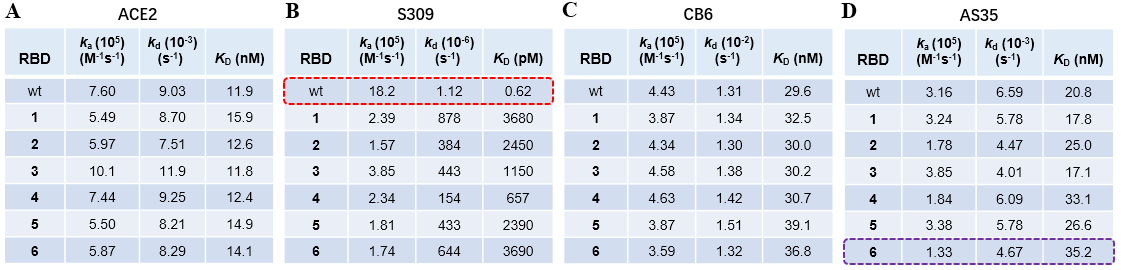
在选择进化压力下,SARS-CoV-2会通过改变糖型甚至糖基化位点完成进化,该合成平台能够高效大量制备均一糖链S-RBD蛋白,有助于开发更有效的抗SARS-CoV-2药物和疫苗,同时也为其他冠状病毒(如SARS, MERS)的研究提供新的思路和策略。
该研究工作获得国家自然科学基金,“生物大分子动态修饰与化学干预”重大研究计划和上海交通大学交叉学科专项资金等项目的资助。上海交通大学化学化工学院博士生叶发荣为本文的第一作者, 上海交通大学化学化工学院化学生物学研究所王平特别研究员为本文通讯作者。该工作得到了中国科学院上海有机所俞飚院士,王婧研究员和复旦大学应天雷教授的大力支持。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202100543

 English
English


