生物体内的核酸中,大部分是不负载遗传信息的非编码核酸,它们广泛参与调控编码核酸的表达。其中,miRNA会与Ago蛋白结合形成RNA诱导沉默复合体(RISC),抑制对应mRNA的表达。人工合成的外源非编码核酸,由于没有传统基因治疗中持续表达和基因融合等风险,近年来被广泛用于生物治疗。miRNA海绵通过与细胞中原癌miRNA结合,可上调抑癌基因表达并抑制肿瘤生长。然而,miRNA海绵的应用面临细胞摄取效率和在细胞内与靶标核酸的结合能力无法平衡这一挑战。一些松散的miRNA核酸结构有利于与靶标的结合,但细胞摄取效率低;相反地,一些致密的miRNA核酸结构可自主高效进入细胞,但位阻效应和静电作用又限制了与靶标的结合。因此,亟需发展一种可平衡细胞摄取与靶标结合的外源非编码核酸结构。
近日,上海交通大学变革性分子前沿科学中心王飞副教授和中国科学院上海应用物理研究所的王丽华研究员、李江研究员合作,利用纳米金粒子和多聚腺嘌呤DNA(polyA-DNA)构建了侧向间隔可编程的球形核酸,并将其用于细胞内原癌miRNA的高效捕获进而抑制肿瘤的生长。该工作以“Compartmenting poly-adenine-based spherical nucleic acids for efficient live-cell microRNA capture”为题,于2021年4月14日在线发表于Angew Chem杂志。焦凯、闫庆龙、郭琳洁为共同第一作者,王飞为通讯作者。
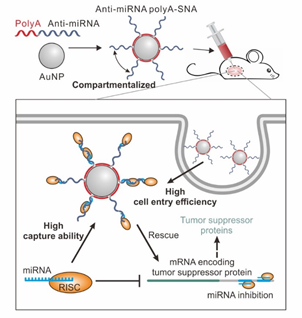
该工作构建了侧向间隔可编程的球形核酸。在保证高细胞摄取的前提下,能够通过polyA长度编程获得最优的靶标捕获能力,进而高效捕获细胞中的原癌miRNA并抑制肿瘤生长。该方法为外源功能核酸构象设计及细胞递送提供了新的策略,有望在细胞内分子识别及基因治疗中有更广泛的应用。

 English
English


